Fúria da cidade
ㅤㅤ ㅤㅤ ㅤㅤ

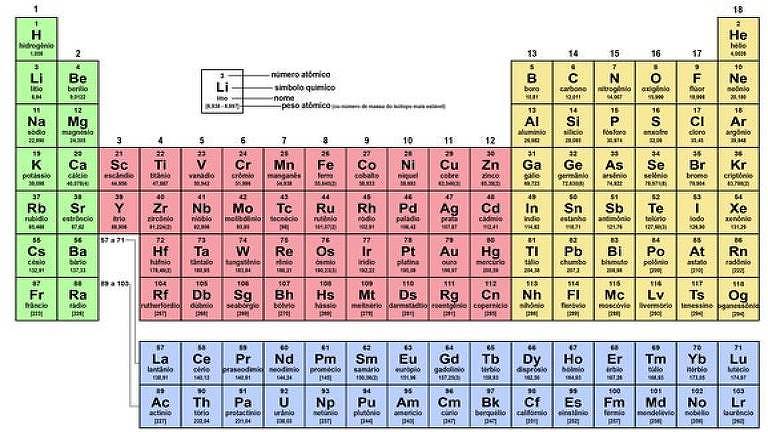
A tabela periódica dos elementos químicos ajudou a sistematizar e a organizar o conhecimento científico Imagem: Getty Images
4

Iniciativa faz parte de esforço simbólico da ONU para 'aumentar a consciência global e a educação em ciências básicas'.
Ela está presente em todos os laboratórios - dos escolares aos mais sofisticados centros de pesquisas científicas do mundo. Estampa livros e apostilas didáticas, pode ser o terror de alunos do Ensino Médio, mas também é um ícone pop. As releituras fazem a alegria de nerds.
Ela, a Tabela Periódica dos Elementos Químicos, ajudou a sistematizar e a organizar o conhecimento científico e é a homenageada deste ano de 2019 pela Organização das Nações Unidas (ONU).
A ONU proclamou 2019 como sendo o Ano Internacional da Tabela Periódica, em um esforço simbólico para "aumentar a sua consciência global e a educação em ciências básicas", conforme declarou em comunicado oficial.
A tabela original reúne os 63 elementos químicos conhecidos, listados em ordem de sua massa atômica e agrupados por suas propriedades físico-químicas.
O anúncio foi celebrado pela comunidade científica. Quando a ONU tornou pública a decisão, a presidente da União Internacional de Química Pura e Aplicada (IUPAC, na sigla em inglês), Natalia Tarasova, afirmou que se sentia "satisfeita e honrada" pelo ano de 2019, enfatizando a importância da "comunicação do conhecimento químico em benefício da humanidade".
A IUPAC emitiu ainda uma nota afirmando que a ONU estava reconhecendo "a importância de aumentar a conscientização global de como a química promove o desenvolvimento sustentável e fornece soluções para desafios globais em energia, educação, agricultura e saúde".
Mendeleev
A escolha do ano não foi por acaso. Há 150 anos, um cientista russo chamado Dmitri Mendeleev (1834-1907) criou a primeira tentativa de organização dos elementos químicos em um formato semelhante ao atual.
Ele foi engenhoso em sua concepção. Primeiro, fez uma cartela para cada um dos então 63 elementos conhecidos - cada qual com seu símbolo, sua massa atômica e suas propriedades físico-químicas. Então as organizou em ordem crescente, conforme suas massas atômicas. Agrupou ainda os elementos com propriedades semelhantes. Nascia sua Tabela Periódica.
"A genialidade de Mendeleev está em sua longa dedicação e empenho na organização dos elementos. Anteriormente outros pesquisadores já organizavam os elementos segundo alguns critérios de periodicidade, mas foi com Mendeleev que atingimos um determinado ápice nesta organização", analisa o químico Luís Roberto Brudna Holzle, professor da Universidade Federal do Pampa em entrevista à BBC News Brasil.
As vantagens em relação aos modelos anteriores eram visíveis. A tabela do russo permitia vislumbrar semelhanças e relações, em análises na vertical, na horizontal e na diagonal. Mendeleev foi ainda o primeiro a deixar espaços vazios, prevendo a descoberta de novos elementos.
"Muitas pessoas criaram tabelas de elementos antes de Mendeleev e alguns perceberam as lacunas possíveis nela. Mas Mendeleev não apenas sugeriu os lugares onde os elementos faltantes poderiam ficar, como também previu suas propriedades", comenta à BBC News Brasil o químico e escritor Mark Lorch, professor de comunicação científica da Universidade de Hull, na Inglaterra.
"Outro ponto fundamental é que ele reconheceu que o peso atômico de um elemento não era o fator importante para descobrir onde ele deveria ser colocado. Em vez disso, Mendeleev priorizou as propriedades do elemento", explica Lorch.
A biografia de Mendeleev também é fascinante. Ele nasceu na cidade de Tobolsk, na Sibéria, caçula em uma família de 17 irmãos. Seu pai era diretor de escola - mas acabou perdendo o cargo quando ficou cedo, no mesmo ano em que o futuro cientista nasceu. A mãe trabalhava em uma fábrica de cristais que havia sido fundada por seu avô.
O menino destacava-se na escola. Quando seu pai morreu e um incêndio destruiu a fábrica onde sua mãe trabalhava, ela decidiu usar todas as economias não para reconstruir o patrimônio, mas sim para investir na educação do filho. Mudaram-se então para Moscou e, em seguida, para São Petersburgo - onde Mendeleev cursaria a universidade.
A organização dos elementos em sua tabela foi feita em 1869 quando ele escrevia um livro de química inorgânica. Ele tinha 35 anos.
"Mendeleev não apenas tabulou os elementos. Ele notou padrões em suas propriedades e então deixou lacunas para os elementos que ainda não haviam sido descobertos. Ele também previu com precisão as propriedades químicas e físicas dos elementos ausentes", afirma Lorch.
"À primeira vista, a tabela de Mendeleev não se parece muito com a que estamos acostumados", completa o professor. "Mas quando você dá uma volta de 90 graus à tabela de Mendeleev, a semelhança com a versão moderna se torna aparente. Por exemplo, os halogênios - flúor (F), cloro (Cl), bromo (Br) e iodo (I)- todos aparecem próximos um do outro."
Vodca
Uma história muito atribuída ao químico é de que ele teria sido inventor da fórmula contemporânea da vodca. Segundo a versão, ele teria padronizado em 40% o teor alcoólico do destilado, quando nomeado, pelo governo russo, responsável por definir as regras básicas da produção.
Essa lenda chegou a ser utilizada até pelo marketing da marca Russian Standard, que chegou a produzir materiais dizendo que "em 1894, Dmitri Mendeleev, o maior cientista de toda a Rússia, recebeu a missão de estabelecer o padrão de qualidade imperial da vodca russa" e que a bebida produzida por eles hoje segue os parâmetros "da mais alta qualidade de vodca russa conforme regras aprovadas pela comissão do governo liderada por Mendeleev".
Mas não é bem assim. É verdade que o cientista foi o chefe do Arquivo de Pesos e Medidas de São Petersburgo, a partir de 1892, e que capitaneou o órgão em um sua transformação em agência governamental. Contudo, pesquisadores afirmam que tal instituição nunca definiu normas da produção de vodca - mas, sim, zelava pela existência daquela que já existia. A proporção etílica de 40% da bebida foi definida pelo governo russo em 1843 - na época, Mendeleev tinha apenas 9 anos.
Importância da tabela
Ao organizar de forma clara as informações importantes e facilitar a criação de relações, a Tabela Periódica de Mendeleev contribuiu para os avanços científicos do século 20. E segue contribuindo.
"O modo mais importante pelo qual a tabela ajuda a desenvolver a ciência é graças à maneira incrivelmente elegante com que ela apresenta uma grande quantidade de informações químicas e físicas", acredita o professor Lorch. "Por isso, é uma ferramenta incrivelmente útil."
"Para um químico, basta uma olhada na tabela para saber como um elemento pode reagir, se é um bom condutor elétrico, qual sua maleabilidade e muito mais", acrescenta Lorch.
O químico Holzle compara a tabela de Mendeleev a um quebra-cabeças, em que as peças faltando passaram a servir de pistas para que futuros pesquisadores descobrissem e caracterizassem os demais elementos. "Após preencher tais espaços, a tabela serviu - e ainda serve - como uma espécie de mapa de comunicação", explica.
"A padronização internacional permite a facilitação na fluência de comunicação entre os químicos de diversas nacionalidades", ressalta o professor. "Além disso, também é útil na área educacional, permitindo a troca de materiais, ideias e criatividade entre professores e estudantes."
"O desenvolvimento da Tabela Periódica dos Elementos é uma das realizações mais significativas da ciência e um conceito científico unificador, com amplas implicações em astronomia, química, física, biologia e outras ciências naturais", enfatiza o comunicado da IUPAC. "É uma ferramenta única que permite aos cientistas prever a aparência e as propriedades na matéria na Terra e no Universo."
"Elementos químicos desempenham um papel fundamental em nossas vidas diárias e são cruciais para a humanidade", afirma a instituição.
Embora a ONU tenha definido que todo o ano de 2019 será em homenagem à Tabela Periódica, sem delimitar uma data exata, algumas são possíveis de ser consideradas. Conforme lembra o professor Lorch, convencionou-se reservar ao 7 de fevereiro o Dia da Tabela Periódica. "É porque foi nesta data, em 1863, que o químico inglês John Newlands publicou uma tabela de elementos baseada naquilo que ele chamou de 'lei das oitavas'", conta.
Um dos tantos precursores da Tabela Periódica, Newlands, que viveu entre 1837 e 1898, propôs uma classificação em que fez uma analogia às oitavas da música - em seu caso, cada elemento químico foi organizado de modo a ter um comportamento semelhante ao oitavo seguinte da tabela.
"Uma alternativa seria celebrar o 6 de março", sugere Lorch. "Afinal, foi nesta data, em 1869, que Mendeleev apresentou sua tabela para a Sociedade Química Russa."
Descobertas recentes
Em termos de design, a Tabela Periódica contemporânea é uma evolução a partir do conceito de Mendeleev. Não foi uma criação estanque.
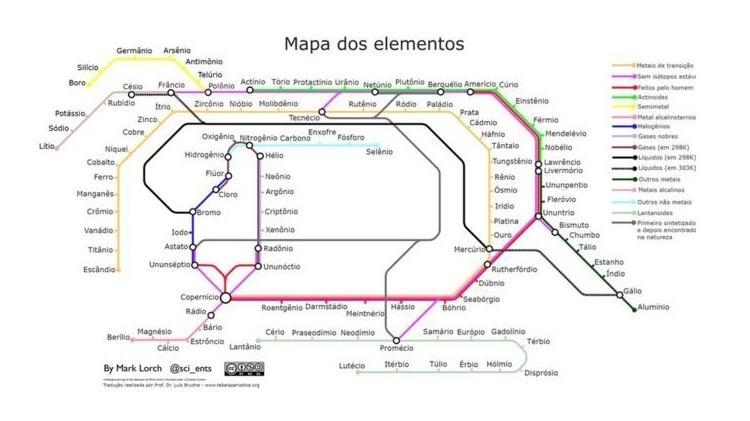
Tabela periódica em formato de linha de metrô, concebida pelo professor Mark Lorch Imagem: Tabela Periódica.org
"A genialidade de Mendeleev estava no que ele deixou de fora de sua tabela. Ele reconheceu que certos elementos estavam faltando, ainda a serem descobertos. Então, onde outros se limitaram a publicaram o que era conhecido, Mendeleev deixou espaço para o desconhecido", pontua Lorch. "Ainda mais surpreendente, ele previu com precisão as propriedades dos elementos que faltavam."
"Os quatro elementos mais recentes da Tabela Periódica, os 113, 115, 117 e 118, foram totalmente adicionados à Tabela Periódica, com a aprovação de seus nomes e símbolos, em 28 de novembro de 2016", informa a IUPAC.
Nihônio (Nh), moscóvio (Mc), tennessino (Ts) e oganessono (Og) estão na sétima linha da tabela e são elementos que não existem na natureza. Foram criados por aceleradores de partículas a partir de colisões de elementos menores. Seus átomos sobrevivem por apenas frações de segundo. Nihônio foi criado três vezes por cientistas japoneses entre 2004 e 2012. Um grupo de pesquisadores americanos e russos produziram moscóvio, tennessino e oganessono.
Outras versões da Tabela Periódica vez por outra são propostas. Professor Lorch fez uma tabela periódica inspirada naquele estilo tradicional de mapas de metrô. No site TabelaPeriodica.org, o professor Holzle disponibiliza uma curiosa versão em códigos QR - basta apontar o celular para cada elemento para obter as informações completas sobre o mesmo.
https://noticias.uol.com.br/ciencia.../por-que-2019-e-o-ano-da-tabela-periodica.htm
------------------------------------------------------------------------------------------------------------------------